免疫沉淀(IP)是一种可以纯化和富集目标蛋白的沉淀技术,在蛋白质组学研究中可用于识别蛋白质与蛋白质之间的相互作用。免疫沉淀是一种重要的技术,用于研究蛋白质之间的存在、相对丰度、大小、上调或下调、稳定性、翻译后修饰(PTMs)以及相互作用。以下为免疫沉淀实验常见问题及解决方案,希望对大家的实验有帮助。
一、背景高
- 样本中有不溶蛋白残留,离心后应立即取出上清。
- 洗涤不充分,优化洗涤缓冲液,通过向洗涤缓冲液中加入去垢剂(0.5-1%NP-40/Triton X-100/Tween-20)、增加盐离子浓度(如250mM NaCl/1-2mM DTT/β-ME),增加洗涤时间和次数来提高洗杂效率。
- 有非特异蛋白和磁珠结合,磁珠用BSA预封闭不充分,确保BSA新鲜,将磁珠和1%BSA 孵育1小时,使用前PBS洗涤3-4次。
- 抗体特异性不好,使用亲和纯化,特异性好的抗体。
- 抗体用量太多导致非特异结合,尝试使用更少的抗体。
- 裂解液中蛋白含量太高,导致洗涤液有很多假阳性蛋白,减少样本用量。
- 蛋白和抗体非特异结合,可以在免疫沉淀之前预先将磁珠和样本孵育,清理样本中可以和磁珠结合的成分,一些研究人员也使用同型对照来预清理裂解液。
- 样本中目的蛋白降解,样本裂解时严格低温操作,加入过量蛋白酶抑制剂。
- 高强度洗脱缓冲液(如SDS-PAGE上样缓冲液)将导致多种非特异蛋白和抗原一起洗脱,温和的缓冲液(如0.1M甘氨酸,pH2.5)可防止此类污染。
二、大量抗体被洗脱
抗体用量太高,尝试减少抗体用量
三、没有检测到目的蛋白洗脱
- 样本中目的蛋白不表达或低水平表达,如果表达水平低,需要增加裂解液用量,但也可能导致非特异结合的增加,所以在免疫沉淀之前需要预先清除裂解液。
- 抗体用量不够,检查抗体用量,提高使用量。
- 目标蛋白没有从磁珠上洗脱,需要确保使用的洗脱缓冲液正确。
- 抗体没有结合磁珠,确保使用的磁珠和抗体亚型匹配,磁珠正确保存,防止变质或干燥。
- 裂解液中盐碱度太高,需要改用低盐碱度裂解液。一般可选NP-40, RIPA, western及IP细胞裂解液。
四、加样顺序对靶蛋白得率的影响
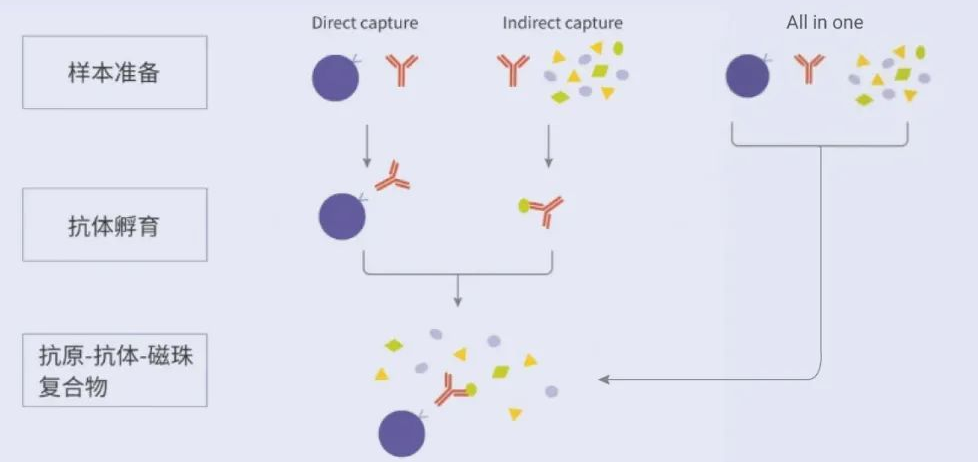
磁珠、抗体、抗原样本混合一起孵育,速度最快,但靶蛋白纯度和得率会很低。
间接法是抗体和抗原样本先结合,再加入磁珠孵育,靶蛋白得率最高,直接法是磁珠先和抗体结合,再加入抗原孵育,对于表达丰度高的蛋白,两种方法差别不大,如果表达丰度低,要选择间接法获得更高的靶蛋白得率。
五、抗原洗脱方法的选择
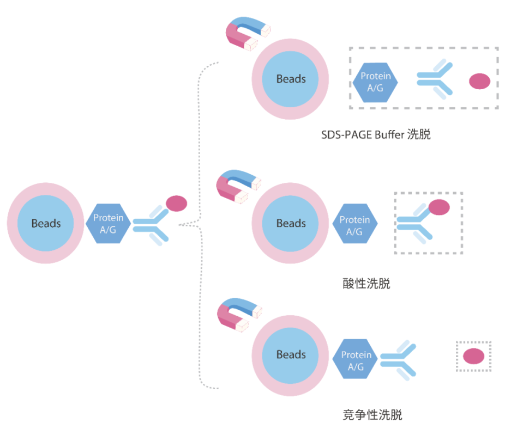
- 变性洗脱法:如果后续进行WB分析,可用此法十分高效,但洗脱下来的蛋白没有生物活性。
- 酸性洗脱法:如果要对洗脱后蛋白进行功能分析,则用酸性洗脱法,0.1-0.15M甘氨酸(pH2.5-3)是最高效的非变性洗脱液。
- 竞争洗脱法:如果靶蛋白带有标签,可用高浓度标签或配体进行竞争性洗脱,洗脱后样本具有生物活性,且没有抗体片段污染。
六、阳性和阴性对照如何设置
阳性对照:就是常说的input,可直接用细胞裂解液或提取好的蛋白进行WB,确定样本中目的蛋白的存在。
阴性对照:如用同型对照作为阴性对照,来排除非特异结合的情况。
七、二抗如何选择
| IP捕获抗体 | WB检测一抗 | WB检测二抗 | 备注 |
| 小鼠来源 | 小鼠来源 | HRP- protein A或HRP-抗小鼠IgG | WB一抗若为mouse IgG1/IgG3亚型,HRP-标记Protein A亲和力较低,可适当降低其稀释度(也可先尝试HRP-抗小鼠IgG二抗); WB一抗若为小鼠IgM/gA亚型,则避免选择HRP- ProteinA,因其不结合。 |
| 兔来源 | HRP抗兔IgG | ||
| 兔来源 | 小鼠来源 | HRP抗小鼠IgG | |
| 兔来源 | HRP- protein A或HRP-抗兔IgG轻链特异性抗体 | HRP-Protein A可以有效降低重链信号以及消减轻链信号的影响,背景干净,适用于检测目的蛋白大小除45-55kDa之外的所有目的蛋白,而目的蛋白大小在45-55kDa之间时,推荐使用HRP标记抗兔IgG轻链特异性二抗。 |












