我们在使用大肠杆菌表达异源蛋白(特别是真核蛋白)时,由于原核表达系统缺乏翻译后修饰,合成速度过快导致二硫键错配,而使目的蛋白常常以不可溶的包涵体表达。
一、有利因素
尽管是没有生物活性的聚集体,但以包涵体形式表达也有其有利的因素:
1、可溶性蛋白在细胞内容易受到蛋白酶的攻击,包涵体表达可以避免蛋白酶对外源蛋白的降解;
2、降低了胞内外源蛋白的浓度,有利于表达量的提高;
3、包涵体中杂蛋白含量较低,且只需要简单的低速离心就可以与可溶性蛋白分离,有利于分离纯化;
4、对机械搅拌和超声破碎不敏感。所以只要能够在体外成功复性,将是大量生产重组蛋白很有效的途径之一。
包涵体在复性前的处理是很重要的。包涵体中除了目的蛋白,也含有一些细菌成分,一些外膜蛋白、质粒DNA和其它杂质,洗涤常用1%以下的中性去垢剂,如Tween、Triton和NP40等加EDTA和还原剂2-巯基苏糖醇(DTT)、β-巯基乙醇等反复多次进行。
包涵体表面吸附的大部分不溶性杂蛋白,常用低浓度的盐酸胍或尿素/中性去垢剂/EDTA/还原剂等洗去。洗涤液pH以与工程菌生理条件相近为宜,使用的还原剂为0.1-5mM。EDTA为0.1-0.3 mM。
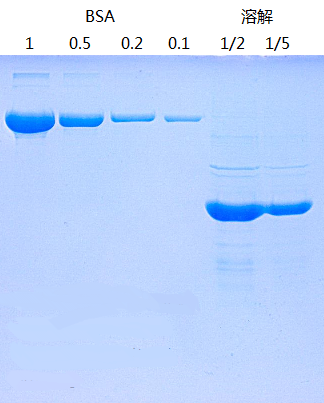
包涵体在经过充分的洗涤-离心几个循环后,杂质已经非常少了,一般来说,包涵体蛋白越纯,复性效果越好。溶解通常用高浓度的变性剂,6-8M的盐酸胍或尿素。尿素在碱性条件下会修饰蛋白的氨基,所以常与Tris-HCl缓冲系统联用。而盐酸胍的变性能力更强,通常在尿素无法溶解时尝试。
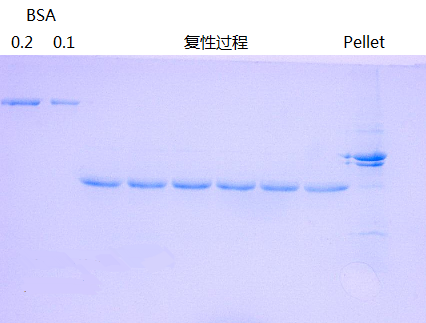
包涵体的复性是一项集理论,经验,运气的复杂工作,没有定理可寻。但还是有一些基本的原则需要遵守。复性的起始浓度需要在0.1mg/ml以下,过高的起始浓度容易造成聚集沉淀。无论是用透析法还是稀释法,变性剂浓度的变化要尽可能的平滑。谷胱甘肽用来促进二硫键的正确搭配,其浓度需要根据二硫键的数量来摸索。
以上就是包涵体纯化和复性的小Tip,希望对大家有所帮助。












