细胞凋亡,也被称为程序性细胞死亡,是一种有序的、由基因控制的细胞死亡方式。它是生物体正常发育和维持内环境稳定的关键机制之一。
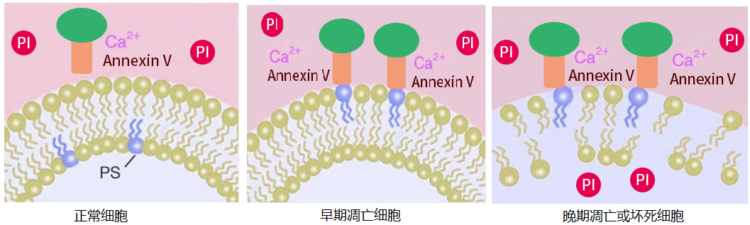
细胞凋亡过程常伴随明显的形态学变化,比如在凋亡早期,细胞膜上磷脂酰丝氨酸(PS)的外翻。Annexin V是一种分子量为35~36kD的Ca2+依赖性磷脂结合蛋白,它对于磷脂酰丝氨酸(PS)有极强的结合力。在细胞凋亡早期,原本只分布在正常细胞膜脂质双层内侧的磷脂酰丝氨酸(PS)会翻向外侧,暴露在细胞外环境中。此时,用标记了荧光素(如FITC)的Annexin V作为荧光探针,可以特异地与外翻的PS结合,从而标记出凋亡早期的细胞。PI(Propidium iodide)是一种核酸染料,它不能透过正常细胞或早期凋亡细胞的完整的细胞膜,但可以透过凋亡晚期或者坏死细胞的细胞膜,与细胞核结合呈现红色。
了解完Annexin V细胞凋亡实验原理后,下面我们一起看一下具体的实验流程。
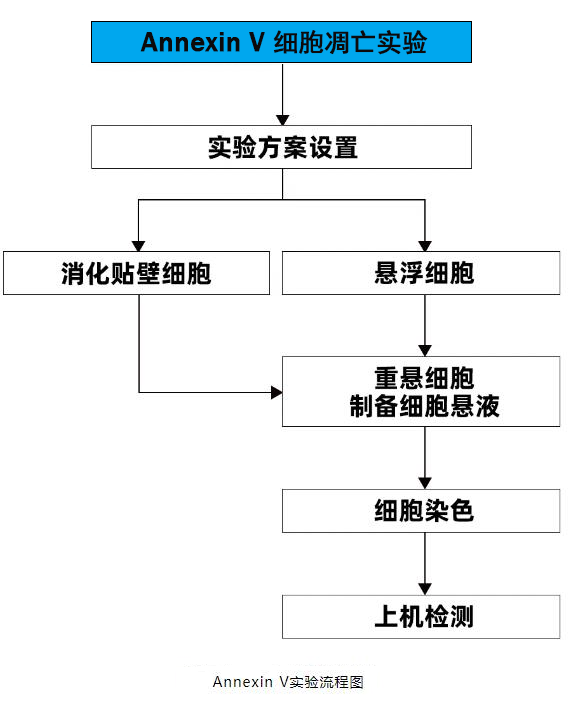
1.获得好的实验结果,需要做好实验前的准备工作,首先得设置好实验方案,具体如下(按照Annexin V-FITC/PI试剂盒用流式细胞仪器检测为例)。
| 组别 | 实验目的 |
| 空白对照(Blank) | 调节阈值和仪器电压 |
| Annexin V-FITC单阳组 | 调节补偿,辅助调节电压 |
| PI单阳组 | |
| 生物学对照(Negative) | 排除实验操作对实验结果的影响,划门依据 |
| 实验组(Test) | 实验结果 |
2.消化贴壁细胞
对于贴壁细胞,先用适量胰酶(不含EDTA)消化细胞,而悬浮细胞可省去此操作。
需要注意以下几点:
1)由于EDTA是Ca2+螯合剂,EDTA会络合Ca2+,从而影响Annexin V与PS的结合,若使用含EDTA的胰酶有可能会造成假阴性,所以建议用不含EDTA的胰酶消化贴壁细胞。
2)如需使用含EDTA的胰酶消化细胞,有必要在染色之前用PBS或结合缓冲液洗涤细胞多次以去除EDTA,从而避免螯合Annexin V所必需的Ca2+。
3)消化细胞的时间不能太久,处理细胞时要轻柔,若过度消化或机械损伤细胞都会导致细胞膜受损,从而造成假阳性。
4)培养基中也存在已经悬浮的发生凋亡或坏死的细胞,因此也收集下来进行检测。
5)检测前细胞密度为80%-90%即可,细胞过密会导致细胞出现大量凋亡,增加了凋亡细胞的比例
3.重悬细胞
无论是悬浮细胞还是贴壁细胞(消化后)进行细胞重悬,轻柔吹打洗涤,并离收集细胞,制备细胞悬液,进行计数。
4.取细胞悬液(细胞总数为1-5×10 ⁵cells)加入荧光标记的Annexin V和碘化丙啶 (PI)轻轻混匀,室温避光孵育15min。
5.染色孵育后,立即进行流式细胞仪检测或荧光显微镜检测。流式细胞仪检测时,以Annexin V-FITC为例,可使用FITC通道(通常是FL1)检测Annexin V-FITC。PE通道(通常是FL2)检测PI。用流式软件进行分析,以FITC为横坐标,PI为纵坐标,绘制双色散点图。
流式结果图:
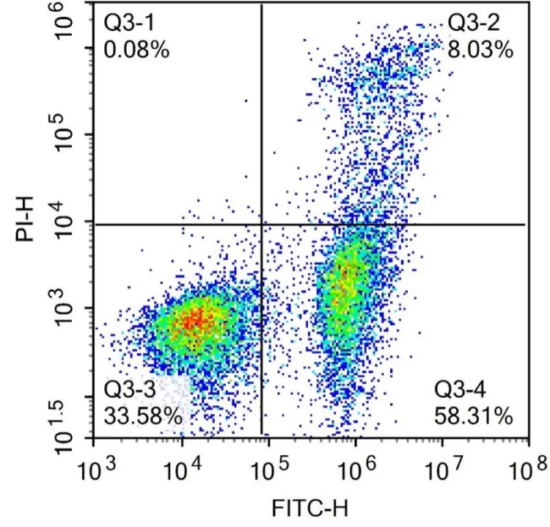
凋亡实验中主要分析细胞凋亡早期,流式凋亡结果图各个象限结果代表如下:
左上象限(Annexin V-/PI+):左上象限为裸核细胞;Annexin V-/PI+象限中细胞数越多,实验结果可信度就越低,因尽量控制本象限细胞比例。
左下象限(Annexin V-/PI-):左下象限为正常的活细胞;
右上象限(Annexin V+/PI+):右上象限为晚期凋亡细胞或坏死细胞,细胞膜损伤的细胞DNA可被PI着染产生红色荧光;
右下象限(Annexin V+/PI-):右下象限为早期凋亡细胞,在细胞凋亡的早期PI无法着染,不会产生红色荧光信号。
1、对照组比处理组凋亡比例高:
a.细胞培养状态不理想;
b.收集细胞后,没有及时染色;
c.过分吹打、震荡,导致细胞膜受损,PS暴露出来。
2、处理组比对照组凋亡比例低:
a.对细胞凋亡诱导刺激强度不足;
b.过度增殖的细胞对凋亡诱导不敏感;
c.贴壁细胞消化时间过长,导致膜表面的PS受损,Annexin V结合位点减少。
菲恩生物细胞凋亡试剂盒相关产品如下:












