标题:High Throughput Screening of Surface Engineered Cyanine Nanodots for Active Transport of Therapeutic Antibody into Solid Tumor
期刊名:Advanced Materials
影响因子:29.4
作者单位:浙江大学
第一作者:秦亚婷
文献地址:https://onlinelibrary.wiley.com/doi/10.1002/adma.202302292
PMID:37405862
引用产品:EH4514 Human PD1/PDL1 Inhibitor Screening Assay Kit
该研究为获得具有高效肿瘤主动递送能力的纳米颗粒提供了高通量筛选方法,为提高治疗性抗体肿瘤渗透能力提供了有效策略。重要的是该策略有望扩展应用于克服其他生物大分子的肿瘤递送屏障和其他复杂的生理屏障。该研究成果以“High Throughput Screening of Surface Engineered Cyanine Nanodots for Active Transport of Therapeutic Antibody into Solid Tumor”为题在线发表于国际权威期刊《Advanced Materials》。浙江大学化学工程与生物工程学院周珠贤副教授为文章通讯作者,秦亚婷博士后为文章第一作者。该工作得到国家重点研发计划项目(2021YFA1201200)、国家自然科学基金项目(21875211和52073249)和浙江省重点研发计划项目(2020C01123)的资助。

生物大分子,如蛋白质和核酸,是生命体生长、繁殖和维持许多重要功能所必需的活性物质。基于抗体等生物大分子的治疗方法具有特异性强、安全性好和疗效高等优点,已在癌症等多种疾病的治疗上显示出了巨大的潜力。与小分子药物类似,生物大分子药物必须被递送至作用靶点才能发挥药效;然而,生物大分子因具有较大的尺寸,更难克服复杂的生理屏障,例如细胞膜和致密的细胞外基质(如肿瘤微环境等)。因此,生物大分子药物的高效递送仍是巨大挑战,是提高其治疗效果和临床转化的关键。
生命体内,细胞利用分子马达蛋白、运输泵和膜纳米管等多种转运体实现生物大分子快速、准确的主动转运。近日,浙江大学周珠贤团队提出:人工合成的载体材料,可以通过合理设计表面化学结构,控制其与细胞的相互作用,进而高效诱导细胞转胞吞行为,使之可以携带生物大分子有效穿越细胞等生理屏障。为了阐明这一想法,作者基于前期发展的花菁染料为核的聚赖氨酸树状大分子(花菁染料纳米点,Angew Chem 2022, 134, e202202128),通过表面修饰不同氨基酸,平行合成了一系列具有不同表面化学、结构精准的Cy5纳米点载体库(G5-AA),采用高通量荧光筛选G5-AA在不同细胞中的内吞、外排和转胞吞行为(图1a),得到了具有优异转胞吞诱导能力的纳米载体G5-R。通过无铜点击化学反应将G5-R与免疫检查点抑制剂αPD-L1偶联得到αPD-L1-G5-R(图1b),并将其负载在纤维蛋白凝胶中得到αPD-L1-G5-R@fibrin。为了测试αPD-L1-G5-R@fibrin应用于局部手术后残余肿瘤免疫治疗的疗效,作者构建了模拟临床的CT26小鼠术后残余肿瘤模型。研究发现主动转运载体G5-R一旦遇到残留肿瘤细胞,就会触发细胞的转胞吞作用,携带αPD-L1高效进入肿瘤组织,与肿瘤细胞表面的PD-L1受体结合,解除免疫抑制,激活免疫系统杀死肿瘤细胞(图1c)。该研究构建的主动转运载体为治疗性抗体等生物大分子的瘤内递送提供了新策略,在克服实体肿瘤递送屏障以及其他生理屏障(如血脑屏障和粘液屏障等)方面有很大的应用前景。
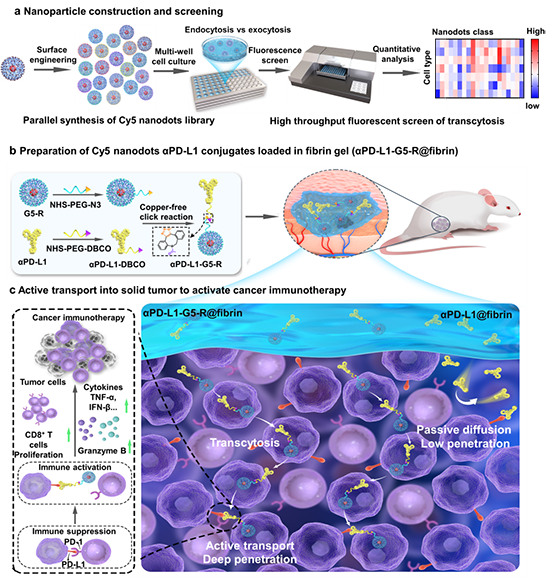
图1. 高通量荧光筛选Cy5纳米点载体库,用于携带αPD-L1在实体肿瘤中主动转运和免疫治疗的示意图。
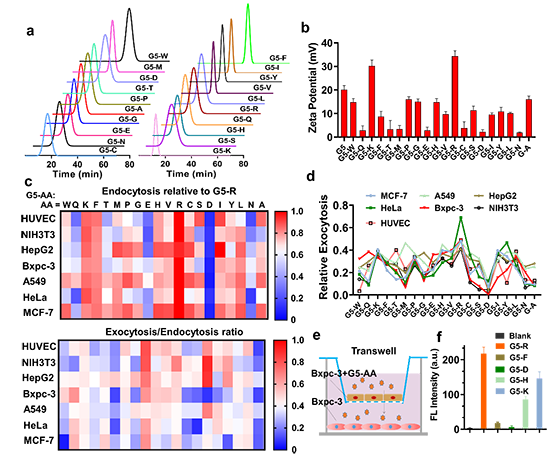
首先,作者通过平行合成构建了不同氨基酸修饰的G5-AA纳米点库,采用HPLC、Maldi-Tof、Zeta电位等表征了载体的精准结构和表面电荷;通过细胞与载体共孵育和酶标仪荧光底读,高通量筛选了G5-AA其在不同细胞中的内吞、外排和转胞吞能力(图2);评估了G5-AA纳米点在体外肿瘤球和体内小鼠耳朵肿瘤模型的瘤内渗透能力(图3),筛选出了具有最佳诱导癌细胞转胞吞作用的纳米点Cy5-G5-R(G5-R)。
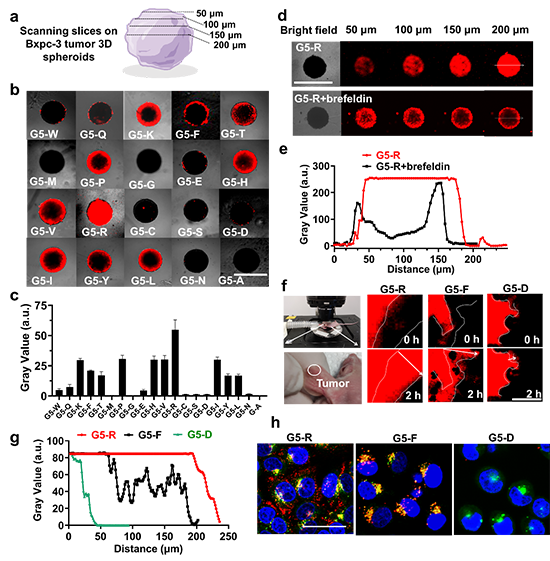
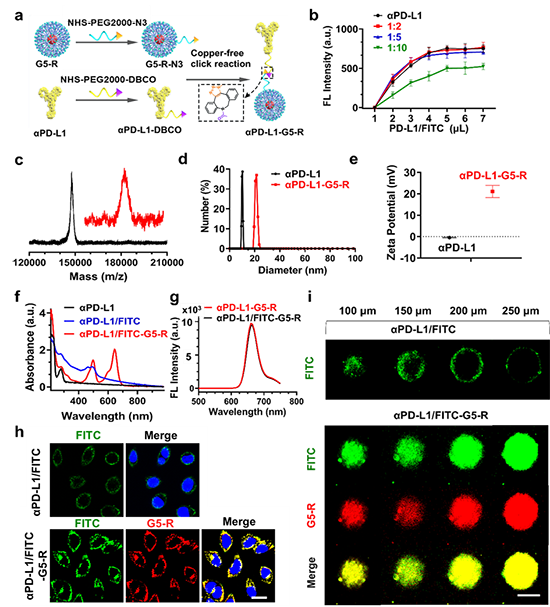
通过无铜点击化学方法,将G5-R与αPD-L1偶联得到αPD-L1-G5-R,采用Maldi-Tof、DLS、Zeta电位和UV等表征了其结构、表面电荷和光学性质;αPD-L1-G5-R与细胞或肿瘤球共孵育实验显示G5-R能够携带αPD-L1高效进入细胞、触发转胞吞作用、主动转运至肿瘤球深处(图4)。
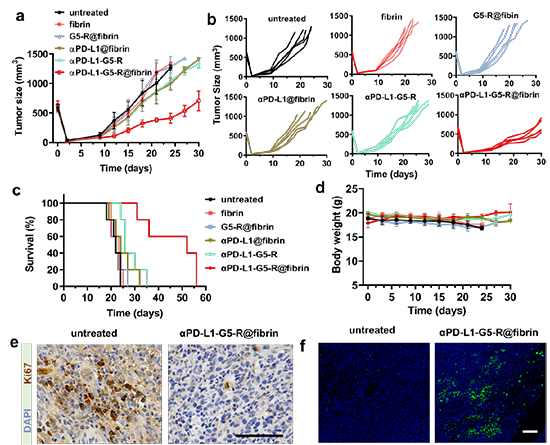
最后,作者将αPD-L1-G5-R@fibrin应用于CT26-luc结肠癌的不完全肿瘤切除模型的局部免疫治疗(图5)。结果显示,与所有对照组相比αPD-L1-G5-R@fibrin展现出了最佳的免疫治疗作用,用αPD-L1-G5-R@fibrin处理的小鼠中有50 %存活了50天以上,与其他组相比,这些小鼠的存活时间明显更长。