基于肿瘤微环境多维重塑的超高效放免协同治疗新策略
标题:Ultra-efficient radio-immunotherapy for reprogramming the hypoxic and immunosuppressive tumor microenvironment with durable innate immune memory
期刊名:Biomaterials
影响因子:14
作者单位:重庆大学医学院
文献地址:https://www.sciencedirect.com/science/article/pii/S0142961223003113
DOI: https://doi.org/10.1016/j.biomaterials.2023.122303
引用产品:
FNab10441 γ-H2AX antibody
FNab00869 beta actin antibody
放疗作为临床上肿瘤治疗的重要手段之一,具有微创、高效等优点。然而肿瘤乏氧与免疫抑制微环境的特点是产生放疗抵抗与治疗后转移与复发的根本原因,往往会导致放疗失败。因此,同时调控肿瘤的乏氧与免疫抑制微环境对提升放疗效果意义重大。
针对临床上由于放疗抵抗及治疗后容易发生转移与复发导致放疗失败的瓶颈问题,近日,重庆大学医学院罗阳教授团队联合西南医院李建军主任团队在生物技术top期刊Biomaterials上联合发表题为“Ultra-efficient radio-immunotherapy for reprogramming the hypoxic and immunosuppressive tumor microenvironment with durable innate immune memory”的研究型论文(2023 Sep 5;302:122303)。该研究通过模板自刻蚀技术构建了一种工程化巨噬细胞来源外泌体包覆的空心MnO2仿生纳米载体(HMnER),通过负载治疗2型糖尿病的一线药物二甲双胍(Met),实现肿瘤乏氧微环境与免疫抑制微环境的多维调控,达到超高效的放疗-免疫协同治疗的同时有效抑制放疗后的转移与复发,该研究首次验证了离子免疫在生物体内放疗后抗肿瘤转移与复发的应用潜力,为开发全新的癌症治疗策略提供了新的研究思路。文章共同第一作者为杨纪春、张冲、陈晓辉,罗阳、李建军、杨纪春为共同通讯作者。

该研究通过模板自刻蚀技术构建了一种工程化巨噬细胞来源外泌体包覆的空心MnO2仿生纳米放疗增敏剂(HMnER),通过负载Met实现肿瘤乏氧与免疫抑制微环境的多维重塑。HMnER一方面可以催化细胞内的过氧化氢产生氧气,并且Met可以显著抑制线粒体的呼吸过程,降低细胞内氧耗率,两者协同以“开源节流”的方式极大地改善肿瘤乏氧微环境,使放疗效果增敏数倍;此外,Met使肿瘤细胞周期阻滞在对放疗的敏感性较高的G2/M期,也对放疗增敏起到了显著的改善作用;另一方面,HMnER降解产生的Mn2+可以有效激活cGAS-STING通路,强化天然免疫细胞应答,重塑肿瘤免疫抑制微环境,产生长期免疫记忆,抑制放疗后肿瘤的转移与复发。
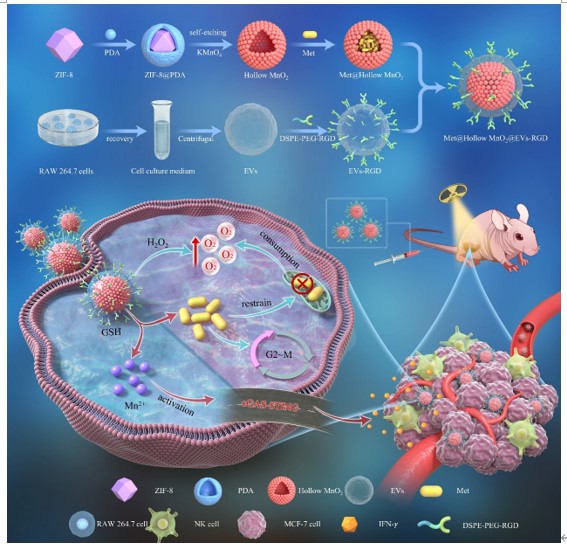
图1. HMnER实现超高效放免协同治疗示意图
该研究采用自刻蚀模板法合成HMnER,作者首先对合成的仿生纳米增敏剂进行了多种表征。结果显示,Hollow MnO2 (HMn) 已成功制备,其水合粒径为78 nm,并具有较高的比表面积,DLS显示出了142 nm的水合粒径分布,并表现出了较高的稳定性。
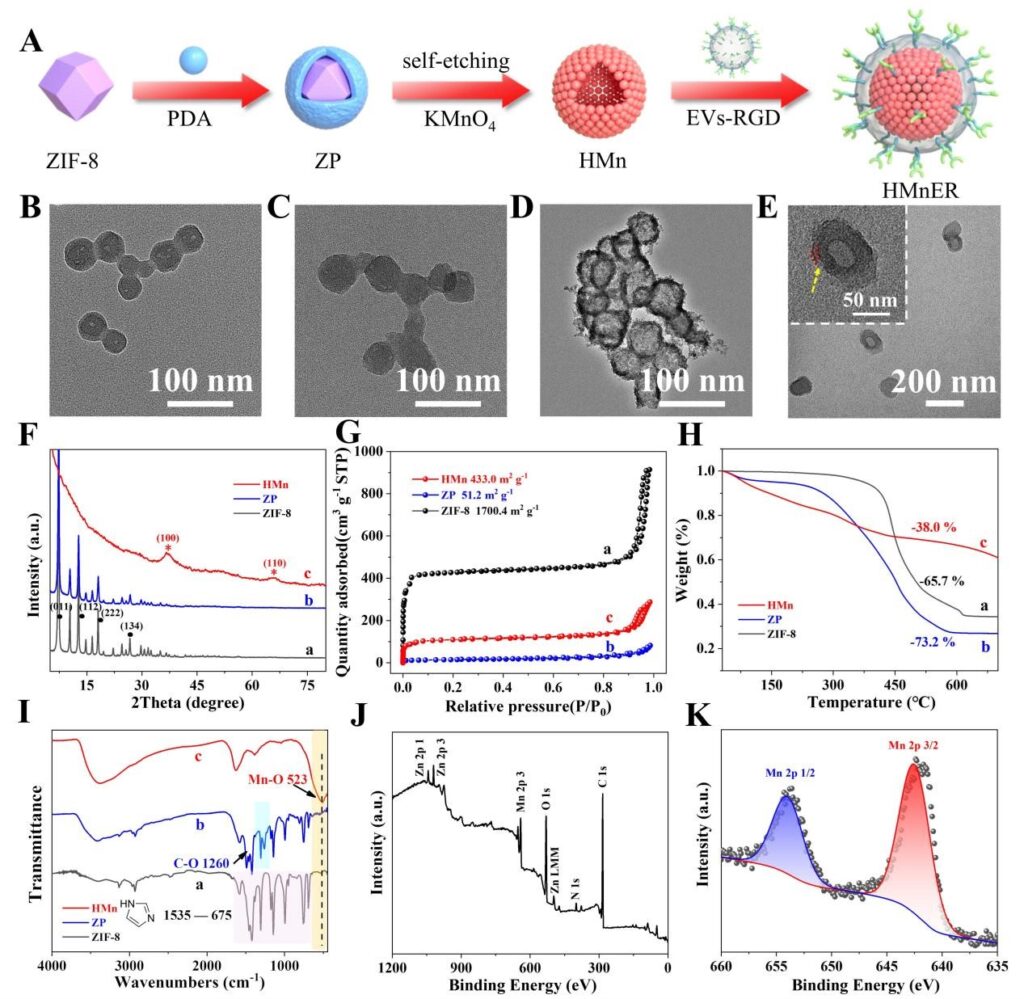
图2. HMnER的制备过程及表征
随后,作者验证了HMnER连续的细胞内化过程,HMnER表现出了较高的癌细胞摄取效率。并且弱酸性和丰富的GSH肿瘤微环境(TME)可以有效解决药物缓释的问题。通过对细胞内氧含量及缺氧诱导因子HIF-1α的测定,表明HMnER 纳米粒子具有较强的H2O2催化能力,产生O2的速率大于传统的实心MnO2纳米粒子。并且Met在一定程度上也缓解了肿瘤细胞的乏氧状态,证明了Met@HMnER可以通过“开源节流”的协同作用极大地改善肿瘤细胞乏氧微环境。
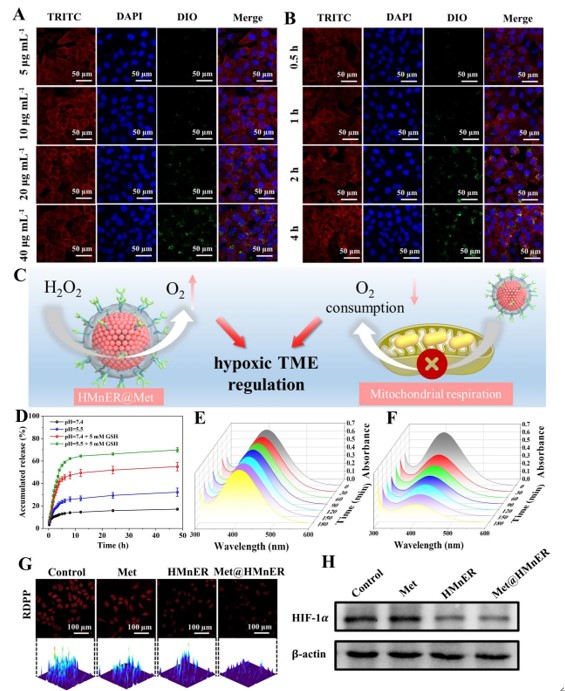
图3. Met@HMnER细胞摄取及乏氧微环境调控能力验证
CCK-8,活死细胞染色等方法证明了Met@HMnER具有显著的肿瘤细胞杀伤能力,并高于传统实心MnO2的放疗增敏能力;通过对凋亡机制的探讨,证明Met@HMnER通过产生ROS诱导线粒体膜电位功能异常,从而导致细胞凋亡。
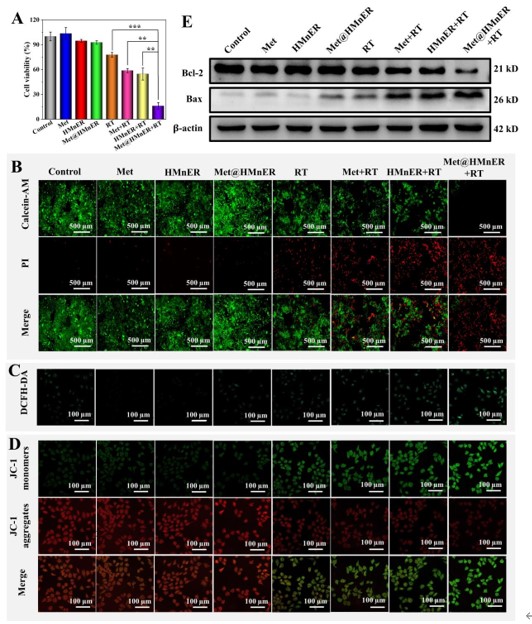
图4. Met@HMnER体外细胞杀伤能力验证
Met@HMnER诱导的放疗增敏主要依赖于DNA双链断裂(DSB),经Met@HMnER共孵育后进行放疗,肿瘤细胞内ATM和γ-H2AX蛋白的表达显著增加,同时Met@HMnER将细胞周期阻滞在具有最高的放射敏感性的G2/M期,验证了Met@HMnER的放疗增敏能力。以NK细胞为细胞模型,验证了Mn2+通过cGAS-STING通路直接激活先天免疫细胞改善免疫抑制微环境的能力。

图5. Met@HMnER放疗增敏及天然免疫激活能力验证
接下来,作者对Met@HMnER的体内抗肿瘤效果进行了研究,H&E与TUNEL染色表明Met@HMnER+RT组的肿瘤组织表现出了最高程度的凝血性坏死和凋亡,验证Met@HMnER优异的放疗增敏效果。同时H&E组织分析、血清相关生化测试、全血分析、溶血实验的结果表明Met@HMnER具有良好的生物相容性及生物安全性,验证了其在体内治疗的应用潜力。
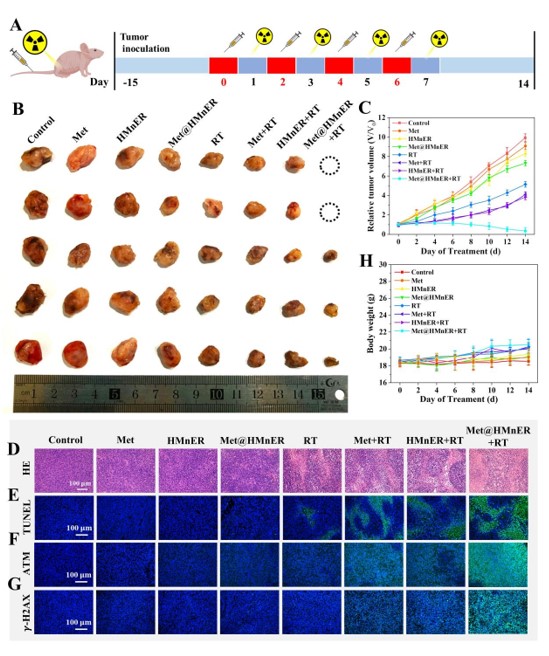
图6. Met@HMnER体内抗肿瘤能力验证
最后,作者通过构建肿瘤原位复发和肺转移小鼠模型评估HMnER调控肿瘤免疫抑制微环境的能力。结果显示HMnER释放的Mn2+能够有效激活NK细胞的天然免疫响应,有效抑制放疗后肿瘤的原位复发与肺转移。
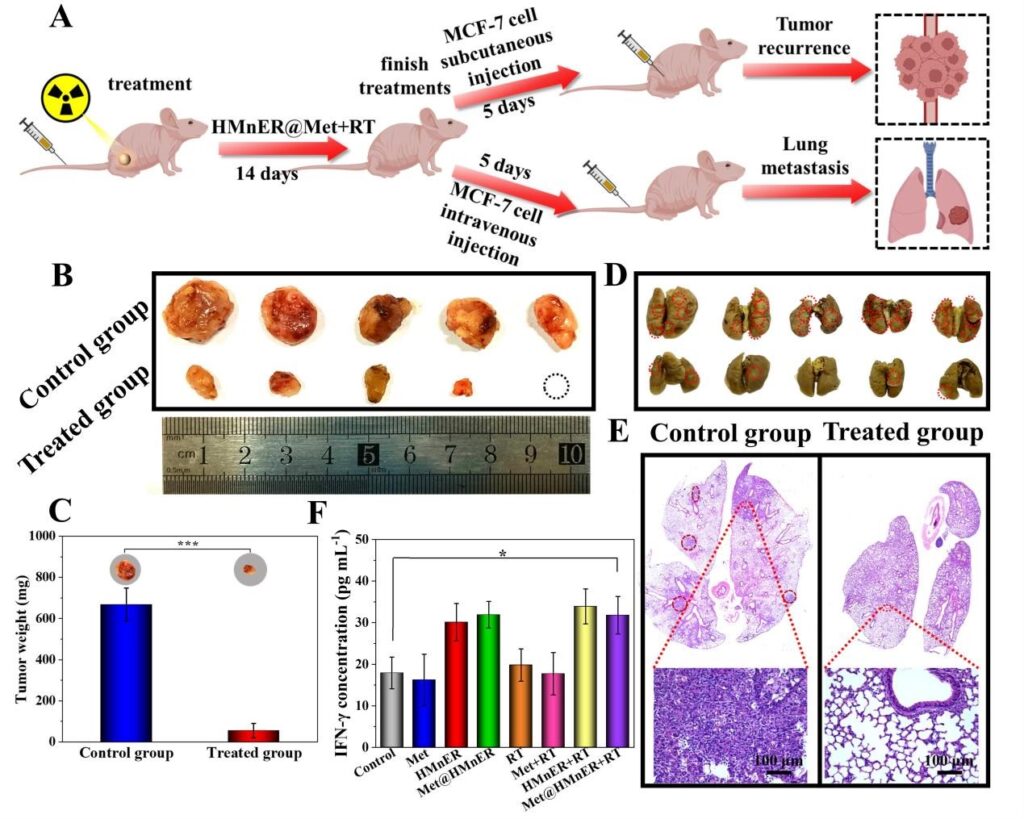
图7. Met@HMnER抗肿瘤原位复发和肺转移能力验证
综上所述,该研究提出一种老药新用的办法,构建了一种功能化外泌体修饰并负载了Met的空心MnO2放疗增敏剂。与传统MnO2放疗增敏剂相比,HMnER@Met纳米材料分别通过空心MnO2催化产生O2与Met抑制细胞呼吸作用两个方面,以“开源节流”的方式极大地改善肿瘤乏氧微环境,表现出了更高效的放疗增敏效果。此外,HMnER@Met降解后产生的Mn2+可以有效激活cGAS-STING通路增强NK细胞的免疫响应,从而实现免疫抑制微环境的调节,降低放疗后肿瘤的转移与复发机率。
图8. 文章TOC图