免疫分型中,一个关键问题是选择合适的抗体浓度。过量或不足的染色试剂会导致非特异性染色增加、信噪比降低以及实验成本上升。因此,确定最佳抗体浓度至关重要。滴定过程旨在找到在所有结合位点饱和且抗体用量最少的情况下,能够有效解析背景阳性信号的试剂浓度。通常从推荐的1X浓度开始,以2X为基础进行6至12个连续的2倍稀释,以评估抗体在靶细胞中的表现。
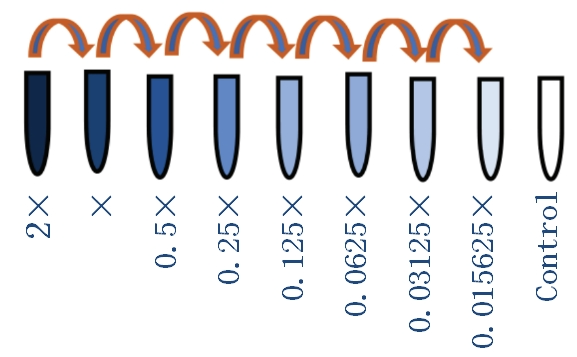
一、抗体滴定方法
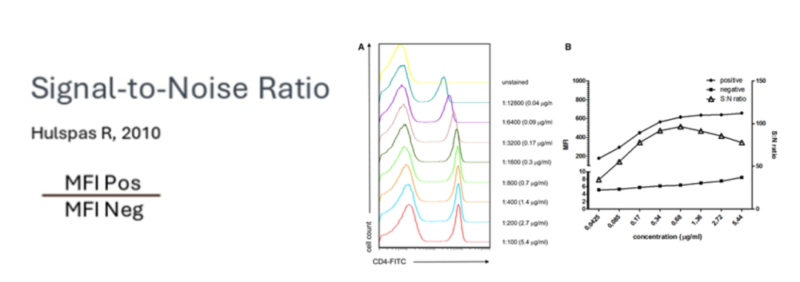
1.最佳滴度评估方法一
完成浓度滴定后,可以通过多种方法评估以确定最佳滴度。最简单的方法是计算信噪比(Signal-to-Noise Ratio, SNR),即阳性群体的平均荧光强度(Mean Fluorescence Intensity, MFI)与阴性群体的MFI之比。最佳的滴度为SNR最高的那个,能够有效区分阳性和阴性信号。通过这一方法,可以准确确定抗体的最佳使用浓度,从而提高实验的灵敏度和可靠性。
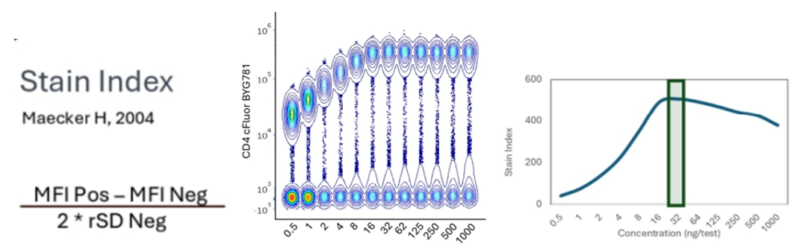
2.最佳滴度评估方法二
另一种评估最佳滴度的方法是计算染色指数(Staining Index, SI)。此方法首先计算阳性群体的平均荧光强度(MFI)与阴性群体MFI之间的差值,然后将该差值除以阴性群体标准偏差的两倍。最佳的滴度为具有最高SI值的滴度,这样可以有效区分阳性和阴性信号,从而优化实验的准确性和可靠性。
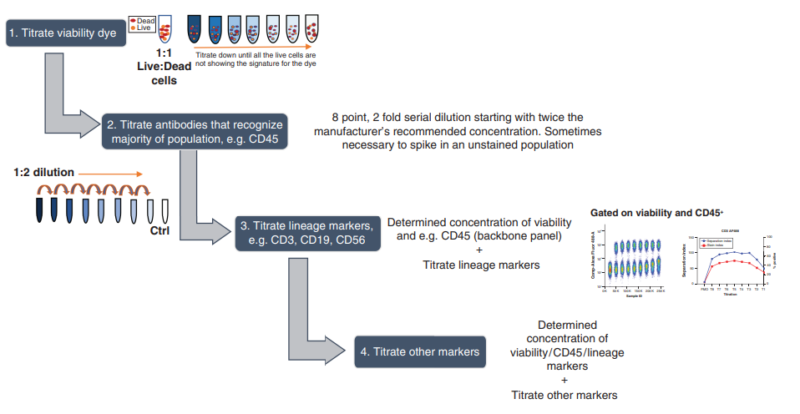
3.连续滴定
上述单独滴定是常用方法,但在多参数多色流式细胞术中,死细胞会干扰结果,而复杂样本中阳性细胞不足也会使最佳滴度评估变得困难。另一种滴定方法是连续滴定。此方法首先确定活性染料和谱系标记物的最佳浓度,然后以它们为基础滴定剩余标记物,以定义最佳滴度。连续滴定特别适用于细胞种类复杂、死细胞较多的多色标记样本。
4.组合滴定
随着多参数多色流式细胞术的广泛应用,单独滴定每个抗体的工作量相当庞大。为提高效率,可以将抗体组合在一起进行滴定。这样一来,抗体成组滴定不仅节省了大量时间和成本,还简化了流程,同时不会影响数据质量,从而显著提升了高参数流式细胞术实验的建立效率。
二、注意事项
1.在抗体滴定时,确保样本中有一定比例的阴性细胞,以准确评估背景染色。如果阴性细胞比例过低,可以在染色后的细胞中添加未染色细胞作为背景荧光参考。
2.同样,要确保阳性细胞充足,以准确评估最佳抗体浓度。若阳性细胞较少,可以在特定亚群中进行连续滴定。
3.最佳滴度应以染色抗体浓度表示,而非稀释倍数。
4.若染色方案、抗体批次或储存条件发生变化,需重新滴定。
5.单独滴定获得的最佳浓度可能因染色量、抗体竞争及多色分辨率损失而需调整。
6.组合滴定时,需考虑将光谱重叠小的抗体-荧光染料偶联物分配到同一组。
7.连续或组合滴定时,抗体体积会稀释其他抗体,因此抗体储备浓度应足够高,以减少稀释影响。
菲恩生物提供适用于人、大鼠和小鼠等模型的流式细胞检测抗体,涵盖多种指标,供用户灵活选择。菲恩生物还提供免费的配色方案、实验指导和数据分析服务,旨在提升科研工作的效率和精准度。通过这些支持,研究人员可以更有效地开展实验,获得可靠的结果。
以下是菲恩生物推荐的流式抗体搭配方案
| 流式抗体推荐 | |||
| 种属 | 细胞群 | 流式抗体搭配 | 货号 |
| Human | T/B/NK细胞群检测 | CD45-PerCP | PCP-30039 |
| CD3-FITC | FITC-30004 | ||
| CD16-PE | PE-30061 | ||
| CD56-PE | PE-30008 | ||
| CD19-APC | APC-30066 | ||
| Human | Th1/Th2 细胞群检测 | CD3-PerCP/Cyanine5.5 | PCP55-30004 |
| CD4-FITC | FITC-30005 | ||
| IFN-γ-PE | PE-30053 | ||
| IL4-APC | APC-30043 | ||
| Mouse | Th1/Th2 细胞群检测 | CD3-PerCP/Cyanine5.5 | PCP55-30002 |
| CD4-FITC | FITC-30128 | ||
| IFN-γ-PE | PE-30074 | ||
| IL4-APC | APC-30026 | ||
| Human | Treg细胞群检测 | CD4-FITC | FITC-30005 |
| CD25-PE | PE-30035 | ||
| CD3-PerCP-Cy5.5 | PCP55-30004 | ||
| CD127-FineTest®647 | F647-30033 | ||
| Mouse | Treg细胞群检测 | CD4-FITC | FITC-30128 |
| CD25-APC | APC-30017 | ||
| FOXP3-PE | PE-30111 | ||












