流式细胞术作为先进的细胞定量分析技术,结合高特异性单克隆抗体,极大地推动了生命科学和医学的发展。然而,由于流式细胞仪的稀缺性和实验操作的复杂性,获取理想结果颇具挑战。基于研发部门的经验,小编总结了几项关键注意事项,包括样本制备、样本标记、设置适当对照等,旨在帮助科研人员克服常见障碍,提升实验成功率。希望这些建议能为您的研究提供有力支持。
一、样本制备阶段
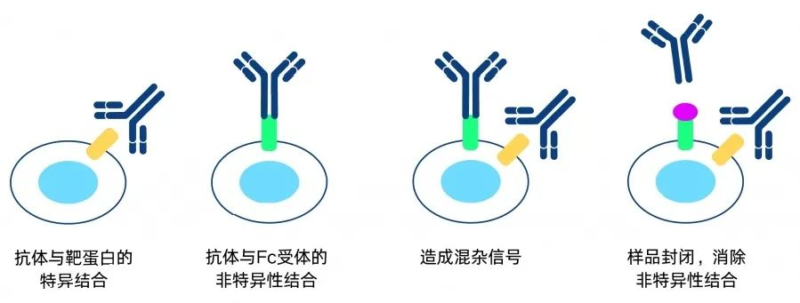
(1)在进行流式细胞实验时,建议使用新鲜采集的样本,无论是悬浮细胞、外周血还是实体脏器样本,以避免因时间推移导致的细胞形态改变和抗原表达下降。并且需要注意封闭样本中的Fc受体。这样可以减少非特异性结合,确保染色的准确性和可靠性,从而提高实验结果的质量。通过适当的封闭步骤,您可以有效避免抗体与Fc受体的非特异性结合,使数据分析更加精准。
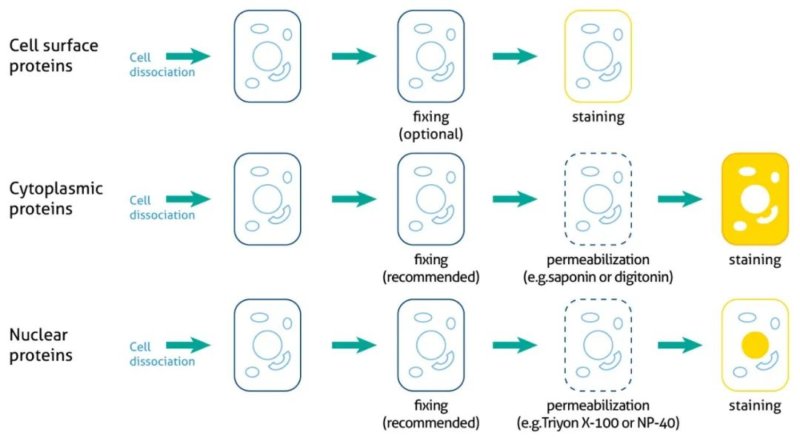
(2)在流式细胞实验中,针对不同类型的蛋白质应采用相应的固定和通透方法。细胞表面蛋白可以直接标记,而胞内蛋白和核蛋白则需先进行固定和破膜处理后才能标记。对于分泌蛋白,需使用Monensin或BFA预处理,以破坏Na+、H+梯度,阻断高尔基体转运和分泌过程,使分泌蛋白滞留在细胞内。选择合适的固定和通透策略,确保抗体能够有效接近目标蛋白,从而提高染色的准确性和可靠性。
二、样本标记阶段
(1)在选择流式抗体时,需确保满足靶标特异性、反应种属及应用实验(如流式细胞术,FC)的基本条件。流式抗体的荧光标记方法主要有直接标记和间接标记两种。为减少实验步骤并保证结果的真实性和准确性,建议在条件允许的情况下优先使用直接标记的抗体进行实验。这样不仅可以简化操作流程,还能提高实验的可靠性和重复性。
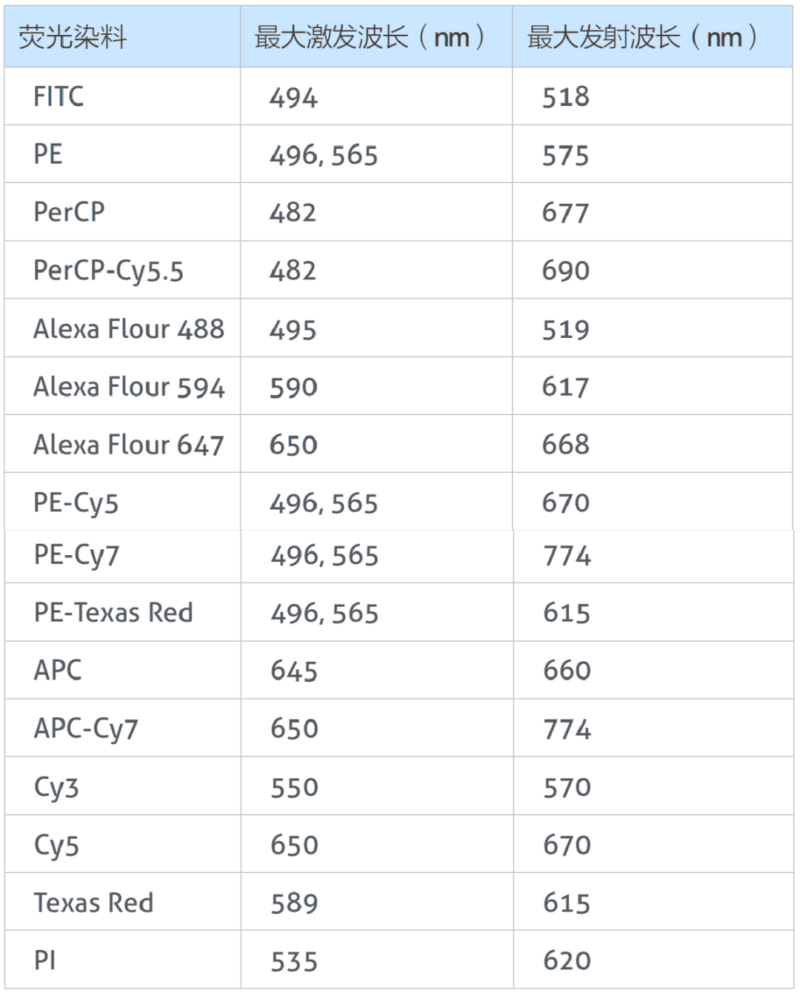
(2)选择荧光染料时,应根据流式细胞仪的激发光和滤光片选择合适波长的荧光素。不同荧光染料的亮度有所差异,常见的排序为:PE > APC > Alexa Fluor 647 > PE-Cy7 > PerCP-Cy5.5 > Alexa Fluor 488 > FITC > APC-Cy7。在多色实验中,建议使用高亮度荧光素标记低表达蛋白,低亮度荧光素标记高表达蛋白,并尽量选择发射光谱重叠小的荧光组合,如FITC/APC,以减少背景干扰,提高数据质量。这样可以确保实验结果的准确性和可靠性。
三、实验对照选择
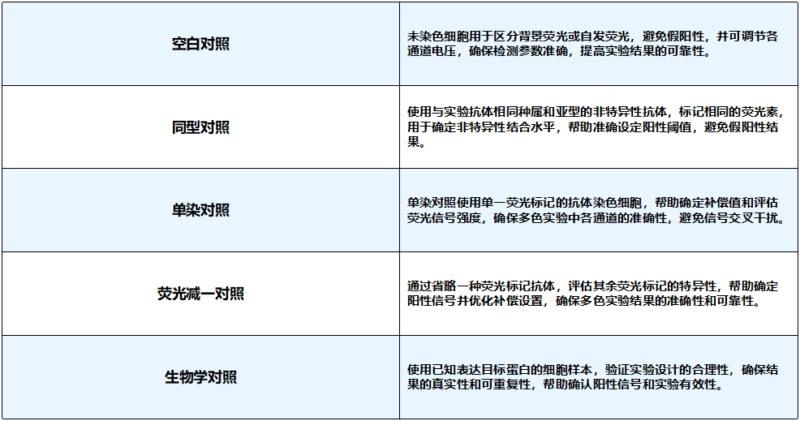
设置合理的对照组是确保流式实验成功的关键,可以有效避免假阳性和假阴性结果。流式实验中应至少包括五种对照:空白对照、同型对照、单染对照、荧光减一对照和生物学对照。这些对照有助于校准仪器、评估背景信号、确定补偿值以及验证实验设计的合理性,从而提高数据的准确性和可靠性。通过精心设置这些对照组,您可以确保实验结果的真实性和可重复性。
在进行流式细胞实验时,选择合适的抗体和荧光染料、设置恰当的对照组以及优化实验步骤都是确保成功的关键。菲恩生物 提供广泛应用于多个研究领域的流式细胞检测抗体,涵盖人、大鼠、小鼠等多种模型,具备丰富的指标和灵活的选择。此外,菲恩生物还提供免费的配色方案、实验指导及数据分析服务,致力于为研究人员提供全面的流式细胞解决方案,助力您的科研工作更加高效和精准。
以下是推荐的流式抗体配方方案,用于检测不同免疫细胞亚群
| 流式抗体推荐 | |||
| 种属 | 细胞群 | 流式抗体搭配 | 货号 |
| Human | T/B/NK细胞群检测 | CD45-PerCP | PCP-30039 |
| CD3-FITC | FITC-30004 | ||
| CD16-PE | PE-30061 | ||
| CD56-PE | PE-30008 | ||
| CD19-APC | APC-30066 | ||
| Human | Th1/Th2 细胞群检测 | CD3-PerCP/Cyanine5.5 | PCP55-30004 |
| CD4-FITC | FITC-30005 | ||
| IFN-γ-PE | PE-30053 | ||
| IL4-APC | APC-30043 | ||
| Mouse | Th1/Th2 细胞群检测 | CD3-PerCP/Cyanine5.5 | PCP55-30002 |
| CD4-FITC | FITC-30001 | ||
| IFN-γ-PE | PE-30074 | ||
| IL4-APC | APC-30026 | ||
| Human | Treg细胞群检测 | CD4-FITC | FITC-30005 |
| CD25-PE | PE-30035 | ||
| CD127-APC | APC-30033 | ||
| Mouse | Treg细胞群检测 | CD4-FITC | FITC-30001 |
| CD25-PE | PE-30017 | ||
| FOXP3-APC | APC-30055 | ||












