流式Panel的设计是流式实验的关键,决定了实验结果的质量。细胞表面抗原、抗体选择、荧光素标记及其他试剂的搭配,对实验结果的精准度起着至关重要的作用。随着技术的进步,现代流式细胞仪器可同时检测40多个参数,为科研人员提供了更深入分析复杂问题的可能,尤其在珍贵样本研究中,合理的Panel设计能帮助获得更丰富的数据,推动研究的深入开展。
一、了解待检测的指标
在设计任何流式Panel时,了解待检测细胞的标记分子(marker)至关重要。在实验前,需要明确所研究细胞的相关marker,并确定其标记与检测方法。需要特别注意的是,同一细胞在不同物种(如人类与小鼠)中的检测marker可能不同。建议首先参考相关文献,此外,OMIPs、BioLegend官网及CD分子等资源也可作为设计Panel的参考,帮助确保实验的准确性与可重复性。
二、对抗原表达量进行分类
抗原的表达量通常分为低表达(low)、中等表达(medium)和高表达(high)。此外,根据表达模式,还可以将其划分为以下三个等级(见表格)。

三、了解平台仪器的配置
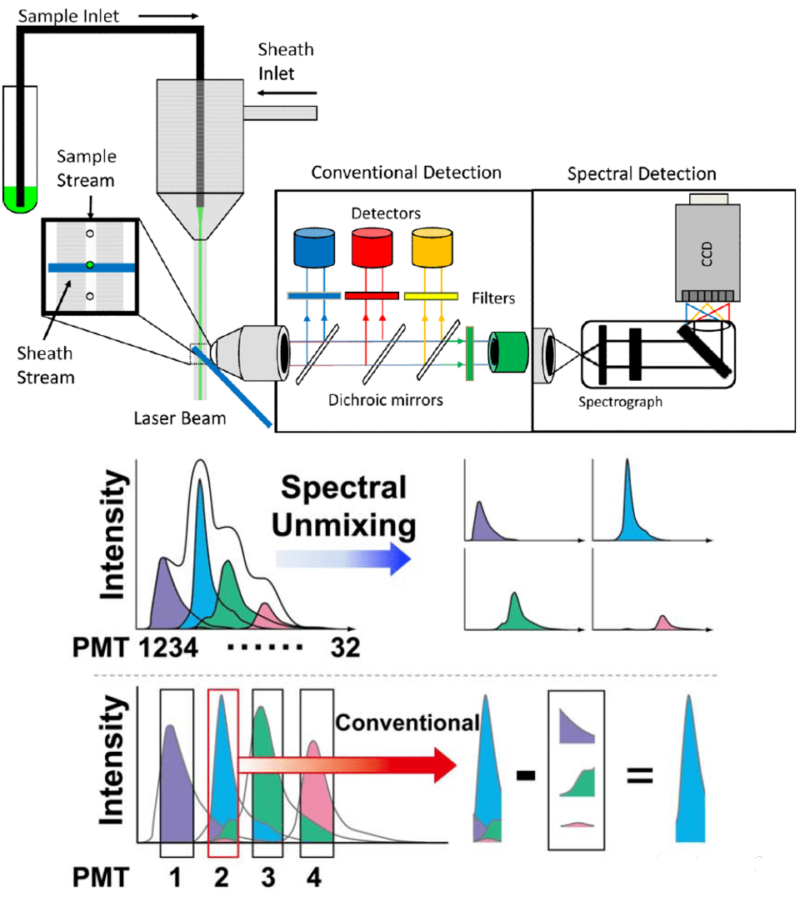
目前的流式细胞仪包括传统流式、光谱流式和质谱流式。虽然这些仪器在Panel设计上遵循相似的思路,但数据读取方式有所不同。传统流式细胞仪通过二向色镜和滤光片组合接收荧光信号,但荧光素的发射光谱通常会有交叉,导致荧光溢漏。因此,进行多色实验时需要准备单染管来计算荧光溢漏比例。
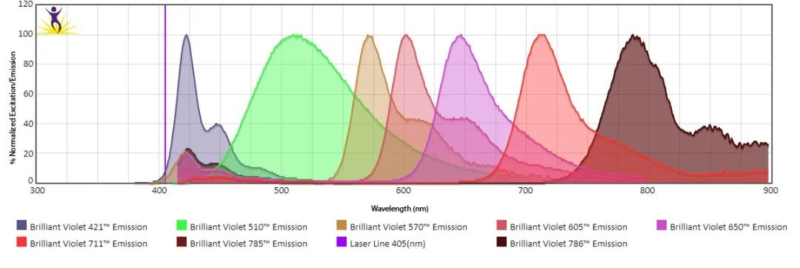
光谱流式细胞仪能够收集荧光素的全光谱特征,每种荧光素都有独特的光谱特性,类似指纹。通过解析这些光谱,光谱流式可以有效区分不同荧光素,从而提高多色实验的精确度。
质谱流式则通过稳定同位素标记细胞,利用飞行时间质谱(TOF-MS)检测离子质量比。
四、荧光素的选择
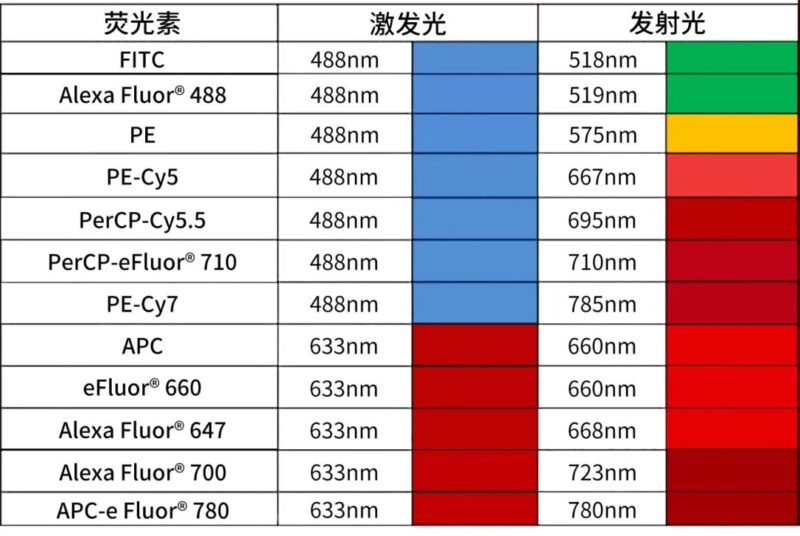
根据仪器配置选择荧光抗体时,可以通过染色指数来判断荧光素的亮度。常见的荧光素可参考下表,而随着新染料的不断推出,选择的范围也越来越广泛。例如,BD新推出的RealBlue和RealYellow系列荧光素,提供了更广泛的选择,实际可用的荧光素种类远超过参考表格中的示例。
五、将抗原及荧光素进行配色
配色时应遵循几个基本原则:首先,强弱搭配原则,即将高表达marker分配给低亮度荧光素,低表达或未知表达量的marker分配给高亮度荧光素。同时,要考虑荧光素的特性,如某些荧光素容易淬灭,不适用于固定破膜的marker。对于共表达的marker,选择spillover较低的染料对,以避免扩散误差。互斥表达的marker可使用干扰较大的荧光素组合,只要不会产生实际干扰。对于溢漏较大的荧光素,应分配给低表达或仅在特定细胞类型中表达的marker。对于组织样品,最好使用死活染料。
六、上机测试多色panel
在正式上机前,需注意以下事项:首先,抗体滴定非常重要,厂家推荐的浓度仅供参考,实际使用时应通过滴定找到最佳浓度,具体可参考之前的文章。其次,选择合适的对照尤为关键,特别是补偿单染管对照和FMO对照。补偿对照的注意事项可参考前文,以确保实验结果的准确性和可靠性。
如果你觉得配色方案过于复杂,可以在购买抗体时直接向公司技术支持请求帮助,我们可以为你提供配色建议。菲恩生物还提供免费的配色方案、实验指导和数据分析服务,致力于提升科研工作的效率与精准度。
以下是菲恩生物推荐的流式抗体搭配方案
| 流式抗体推荐 | |||
| 种属 | 细胞群 | 流式抗体搭配 | 货号 |
| Human | T/B/NK细胞群检测 | CD45-PerCP | PCP-30039 |
| CD3-FITC | FITC-30004 | ||
| CD16-PE | PE-30061 | ||
| CD56-PE | PE-30008 | ||
| CD19-APC | APC-30066 | ||
| Human | Th1/Th2 细胞群检测 | CD3-PerCP/Cyanine5.5 | PCP55-30004 |
| CD4-FITC | FITC-30005 | ||
| IFN-γ-PE | PE-30053 | ||
| IL4-APC | APC-30043 | ||
| Mouse | Th1/Th2 细胞群检测 | CD3-PerCP/Cyanine5.5 | PCP55-30002 |
| CD4-FITC | FITC-30001 | ||
| IFN-γ-PE | PE-30074 | ||
| IL4-APC | APC-30026 | ||
| Human | Treg细胞群检测 | CD4-FITC | FITC-30005 |
| CD25-PE | PE-30035 | ||
| CD127-APC | APC-30033 | ||
| Mouse | Treg细胞群检测 | CD4-FITC | FITC-30001 |
| CD25-PE | PE-30017 | ||
| FOXP3-APC | APC-30055 | ||












