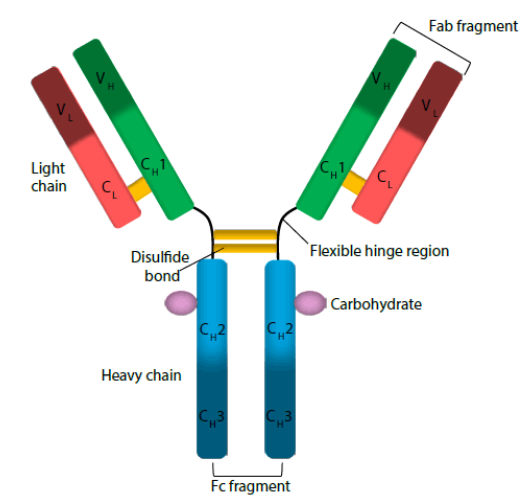
在流式细胞术实验中,非特异性结合是影响结果准确性的关键因素。高非特异性不仅会导致假阳性信号的产生,还可能掩盖真实的生物标志物。因此,了解非特异性的来源及其影响显得尤为重要。通过优化实验条件、选择合适的抗体和使用严格的对照,可以有效减少非特异性,提高数据的可靠性,从而为后续的生物学研究和临床应用奠定坚实基础。
在排查非特异性抗体结合之前,首先需了解抗体的结合方式。如图所示(A-F),A与非目标抗原结合,B与Fc受体结合,C与目标抗原结合但表位不正确。D-F则显示偶联的荧光染料与非目标抗原、Fc受体和目标抗原的结合情况。图G-I中,G与共享的抗原表位结合,H与Fc受体结合,而I则同时与目标抗原及其表位结合,形成特异性抗体。
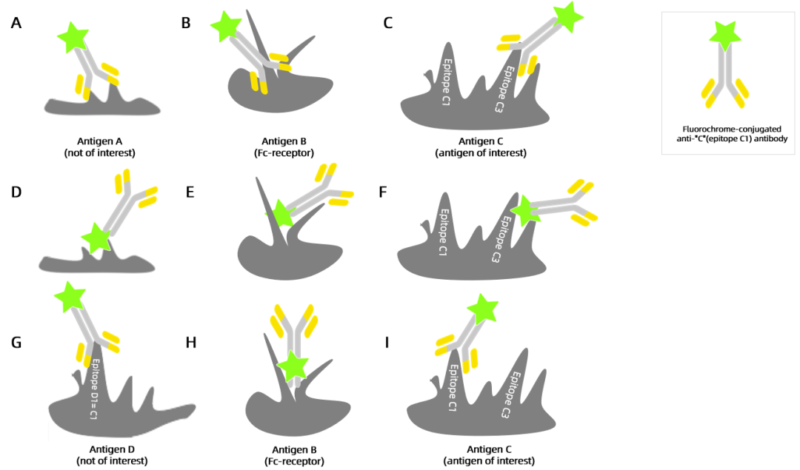
下面分析非特异性抗体结合原因:
1.抗体使用过量
过量抗体会与低亲和力的非目标靶标结合,降低信噪比。建议按照说明书推荐的用量进行滴定,以确定最佳浓度。此外,抗体孵育时间应适度,参考厂家建议并根据实验情况进行调整。
2.非特异性黏附
所有细胞都能不同程度地黏附蛋白,抗体作为一种蛋白也会通过非特异性相互作用与细胞结合。为减少这种结合,可以在洗涤液和染色液中添加适量的胎牛血清(FBS)或牛血清白蛋白(BSA)。
3.排查是否抗体与Fc受体发生了结合
Fc受体是免疫细胞表面的抗体结合蛋白,部分细胞(如单核细胞、巨噬细胞、中性粒细胞和B细胞)表面表达Fc受体。在流式实验中使用的抗体通常含有Fc段,因此在抗体染色过程中,Fc段可能与细胞表面的Fc受体结合,从而导致非特异性结合。
4.选择高特异性的抗体
抗体的交叉反应可能导致识别目标抗原表位以外的相似表位。菲恩生物流式抗体开发流程,确保了抗体的卓越性能和高特异性。该抗体对精细抗原表位具有出色的识别能力,为科研和临床研究提供了更高的灵敏度。
5.减少背景信号
Fc受体与抗体的结合是显而易见的,但较少人知的是,某些荧光染料也能结合Fc受体。例如,PE染料可以与小鼠的Fc-γ-RII(CD16)和Fc-γ-RIII(CD32)结合。此外,花青素染料(如Cy系列)及其相关串联染料(如PE-cy5、APC-cy7)也容易与Fc受体结合,特别是在使用FcR细胞(如单核细胞)时。这种结合无法通过Fc受体阻断剂抑制,因此建议避免使用花青素类荧光染料。
6.洗涤不充分
通过增加洗涤次数并使用合适的洗涤缓冲液,可以有效去除未结合的抗体,从而减少非特异性结合的影响。
7.存在死细胞
死细胞具有黏性,容易导致高非特异性结合,主要是由于其暴露的DNA。为排除死细胞,可以使用DNA结合染料(如7-AAD或PI)进行活死细胞鉴定。如果因荧光搭配问题无法添加活死染料,则可利用FSC/SSC散点图中的Viable门来帮助区分活细胞与死细胞。
在流式细胞实验中,选择合适的抗体和荧光染料、设置恰当的对照组以及优化实验步骤是确保成功的关键。菲恩生物提供多种适用于人、大鼠、小鼠等模型的流式细胞检测抗体,涵盖丰富的指标和灵活的选择。此外,菲恩生物还提供免费的配色方案、实验指导及数据分析服务,旨在为研究人员提供全面的流式细胞解决方案,助力科研工作高效、精准。
以下是菲恩生物推荐的流式抗体搭配方案
| 流式抗体推荐 | |||
| 种属 | 细胞群 | 流式抗体搭配 | 货号 |
| Human | T/B/NK细胞群检测 | CD45-PerCP | PCP-30039 |
| CD3-FITC | FITC-30004 | ||
| CD16-PE | PE-30061 | ||
| CD56-PE | PE-30008 | ||
| CD19-APC | APC-30066 | ||
| Human | Th1/Th2 细胞群检测 | CD3-PerCP/Cyanine5.5 | PCP55-30004 |
| CD4-FITC | FITC-30005 | ||
| IFN-γ-PE | PE-30053 | ||
| IL4-APC | APC-30043 | ||
| Mouse | Th1/Th2 细胞群检测 | CD3-PerCP/Cyanine5.5 | PCP55-30002 |
| CD4-FITC | FITC-30001 | ||
| IFN-γ-PE | PE-30074 | ||
| IL4-APC | APC-30026 | ||
| Human | Treg细胞群检测 | CD4-FITC | FITC-30005 |
| CD25-PE | PE-30035 | ||
| CD127-APC | APC-30033 | ||
| Mouse | Treg细胞群检测 | CD4-FITC | FITC-30001 |
| CD25-PE | PE-30017 | ||
| FOXP3-APC | APC-30055 | ||












